

ISO9001认证到期处理指南:再认证流程与关键注意事项
ISO9001认证是企业质量管理体系的核心资质,其有效期为3年。认证到期后,企业需通过再认证流程维持资质,同时借此契机优化管理体系。以下是再认证的标准化流程与关键控制要点,结合行业实践总结而成:

一、再认证核心流程
1. 前期准备阶段(认证到期前6-12个月)
- 体系全面审计:对现有质量管理体系(QMS)进行全要素审查,重点检查质量手册、程序文件与ISO9001:2015标准的匹配性,更新过时条款(如客户投诉处理流程、供应商评估机制)。
- 管理评审升级:分析过去三年客户满意度、内部审核不符合项整改率等数据,识别体系薄弱环节(如交付及时率低于行业基准),制定改进计划。
- 供应商协同审核:对关键供应商开展联合审核,确保其质量保证能力与企业体系要求一致,避免因供应链问题影响审核结果。
2. 提交再认证申请
- 材料准备:提交营业执照、到期证书、更新后的质量手册及程序文件、过去三年内部审核报告、管理评审记录等。
- 认证机构选择:优先选择国家认监委(CNCA)认证的机构,评估其审核员专业度与服务响应速度。
3. 现场审核阶段
- 第一阶段(文件审查):审核组重点检查文件的逻辑性与可操作性,例如生产流程图是否覆盖所有关键控制点。
- 第二阶段(现场验证):通过“观察-访谈-记录追溯”验证体系运行有效性,重点关注:
- 过程控制:检验流程是否严格执行首检、巡检、终检制度;
- 数据追溯:生产批次记录、设备校准证书、不合格品处理单据的完整性;
- 人员能力:一线员工对岗位质量规范的掌握及异常处理流程。
4. 不符合项整改与认证决定
- 整改要求:针对审核组提出的不符合项(如检验设备校准超期),需在20个工作日内提交纠正措施计划,包括根本原因分析、临时与永久性改进方案及验证记录。
- 认证结果:认证机构根据整改效果决定是否颁发新证书。若存在重大不符合项(如连续两年未达成质量目标),可能面临证书暂停或撤销。
二、关键注意事项
1. 时间管理
- 建立倒计时管控机制,将再认证任务分解为月度里程碑(如第9个月完成文件修订,第6个月启动内部审核),避免因节点延误导致审核延期。
2. 文件与记录管理
- 采用电子化文档系统(如DMS)实现文件版本自动更新与权限控制,确保所有记录保存周期符合法规要求(如医疗器械行业需保存5年以上)。
3. 内部审核与培训
- 内部审核:至少进行两次覆盖全体系的内部审核,重点验证关键控制点(如采购验收、生产过程监控)的合规性。
- 人员培训:管理层需掌握质量战略规划,基层员工需熟练执行岗位SOP,审核员应取得CNAS认可资质。
4. 不符合项处理
- 根本原因分析:使用5Why分析法或鱼骨图工具,避免仅解决表面问题。例如,若发现检验记录缺失,需追溯至培训不足或流程设计缺陷。
- 预防措施:整改后需通过管理评审确认措施有效性,并纳入体系文件(如更新检验操作指南)。
5. 持续改进机制
- 将再认证视为体系升级契机,引入数字化工具(如MES系统)实现质量数据实时分析,或与ISO14001环境管理体系融合,提升综合管理效能。
三、常见风险与应对策略
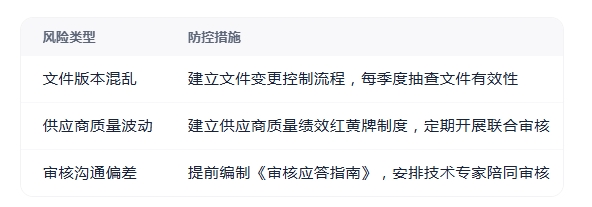
通过系统化再认证管理,企业不仅能维持ISO9001资质,更能借此契机实现质量体系迭代升级。建议将再认证视为管理优化的契机,而非单纯应付审核的短期任务,从而真正释放质量管理体系的价值。

网址:szzkcx.com
客服QQ:395601381
客服电话:158-9988-3488
联系电话:13510000845
邮箱:16949@88.com
地址:深圳市罗湖区黄贝街道深南东路集浩大厦A1206
 微信公众号
微信公众号
 手机网站二维码
手机网站二维码